=> yakni suatu golongan asam organik alifatik yang mana memiliki gugus karboksil (-COOH)
seluruh asam karboksilat adalah asam lemah. Di dalam pelarut air, sebagian molekul daripadanya terionisasi dgn melepas atom hidrogen menjadi ion H+.
Asam karboksilat bisa mempunyai lebih dari satu gugus fungsional. Ada Asam karboksilat yang memiliki dua gugus karboksil disebut
asam dikarboksilat <alkandioat> apabila tiga disebut asam trikarboksilat, [Alkantriowat] dan dst.
Pengertian Asam Karboksilat
Asam karboksilat ialah segolongan senyawa organik yang dicirikan oleh gugus karboksil yaitu nama yang berasal dari nama gugus fungsi karbonil dan hidroksil. Rumus umum asam karboksilat ialah RCOOH. Asam karboksilat tergolong asam karena senyawa ini mengion dalam larutan, menghasilkan ion karboksilat dan proton.
Dalam asam karboksilat gugus -COOH terikat pada gugus alkil (-R) atau gugus aril (-Ar). Meskipun yang mengikat gugus –COOH daspat berupa gugus alifatik atau aromatic, jenuh atau tidak jenuh, tersubstitusi atau tidak tersubstitusi sifat yang diperlihatkan oleh gugus –COOH tersebut pada dasarnya sama. Di samping terdapat asam yang mengandung satu gugus karboksil (asam monokarboksilat), diketahui juga terdapat asam yang memiliki dua gugus karboksil (asam dikarboksilat) dan tiga buah gugus karboksil (asam trikarboksilat). Perbedaan banyaknya gugus –COOH ini tidak mengakibatkan perubahan sifat kimia yang mendasar.
Struktur dan Ikatan Dalam Asam Karboksilat
Atom karbon karbonil dalam gugusan karboksil adalah sp2 hibrida. Setiap atom oksigen mempunyai dua pasang elektron sunyi. Atom-atom oksigen ini bersifat elektonegatif dibandingkan karbonil-karbonil dan hidrogen hidroksil. Jadi, gugusan karboksil polar.
Karena polaritas dari ikatan O-H dan karena ion karboksilat (RCO2-) adalah resonansi stabil, asam karboksilat dapat kehilangan proton menjadi basa kuat atau basa agak kuat.
Tata Nama Asam Karboksilat
Karena banyak terdapat dialam, asam-asam karboksilat adalah golongan senyawa yang paling dulu dipelajari oleh kimiawan organik. Karena tidak mengherankan jika banyak senyawa-senyawa asam mempunyai nama-nama biasa. Nama-nama ini biasanya diturunkan dari bahasa Latin yang menunjukkan asalnya. Banyak dari asam ini mula-mula dipisahkan dari lemak sehingga sering dinamakan sebagai asam-asam lemak. Untuk memperoleh nama IUPAC suatu asam karboksilat terakhir diperlukan awalan kata asam dan akhiran at. Asam-asam bersubstitusi diberi nama menurut dua cara. Dalam sisitem IUPAC, nomor rantai dimulai dari asam karbon pembawa gugus karboksil dan substituen diberi nomor lokasi. Jika nama umum yang digunakan lokasi substituen dilambangkan dengan huruf latin, dimulai dengan atom karbon α. Jika gugus karboksilat dihubungkan dengan cincin, akhiran karboksilat ditambahkan pada nama induk sikloalkana. Asam-asam aromatic juga diberi tambahan –at pada turunan hidrokarbon aromatiknya.
Sifat-Sifat Asam Karboksilat
Wujud dari asam karboksilat tergantung dari jumlah atom C-nya, untuk senyawa asam karboksilat yang memiliki atom C kurang dari 10, maka wujud zat tersebut adalah cair pada suhu kamar. Sedangkan asam karboksilat yang memiliki panjang rantai C 10 atau lebih berwujud padat.
Asam karboksilat dengan panjang rantai 1-4 larut sempurna dalam air, sedangkan asam karboksilat dengan panjang rantai 5-6 sedikit larut dalam air dan asam karboksilat dengan panjang rantai lebih dari 6 tidak larut dalam air. Asam karboksilat larut dalam pelarut organik (seperti eter, alkohol dan benzena). Semua asam karboksilat merupakan asam lemah dengan Ka= + -1×10-5.
Asam karboksilat memiliki titik didih yang tinggi (lebih tinggi daripada alkohol), karena dapat membentuk ikatan hidrogen yang kuat.
· Reaksi dengan Basa Kuat
Reaksi Asam karboksilat dengan basa kuat akan membentuk garam dan air. Garam karboksilat hasil reaksi merupakan sabun. Reaksi ini sering disebut juga dengan reaksi penyabunan.
· Reaksi substitusi
Reaksi dengan halida (PX3, PX5 dan SOX2) akan menghasilkan suatu asilhalida. Dan reaksi dengan alkohol akan menghasilkan suatu ester dan H2O.
· Reaksi Reduksi menggunakan katalis CaAlPH4akan menghasilkan alkohol primer.
· Reaksi dehidrasi (penghilangan molekul H2O) akan menghasilkan anhidrida asam karboksilat.
Asam karboksilat bersifat polar. Asam karboksilat rantai kecil (1 - 5 C) dapat larut dalam air, dan sedangkan pada rantai yang memiliki lebih panjang semakin kurang larut dikarenakan sifatnya yang hidrofobik dari rantai alkil. Asam karboksilat untuk rantai yang lebih panjang cenderung larut pada pelarut yang boleh dikatakan kurang polar seperti eter dan alkohol.
Sifat Asam Karboksilat
*titik didih
Nah titik didih asam karboksilat cenderung memiliki titik didih yang lebih tinggi drpd air dan juga senyawa organik lainnya.Disebakan lebih tingginya karena luas permukaan yang besar sertapun kecendenrungan molekulnya membentuk dimer yang stabil. Semisalnya alkohol dari golongan alkanol.Hal tersebut dikarenakan asam karboksilat memiliki dua ikatan hidrogen, sedangkan alkohol hanya punya satu ikatan hidrogen.Dan sementara itu, sementara itu, berdasarkan sifat kelarutannya dalam air. Berbeda-bedanya sifat asam karboksilat tergantung jumlah atom karbonnya.
*Bau
Asam karboksilat memiliki bau yang menyengat. Contoh Yang paling umum adalah asam asetat pada cuka dan asam butanoat juga pada mentega tengik. ester dari asam karboksilat memiliki bau yang harum dan banyak digunakan untuk pengharum atau farpum.
*Keasaman
Asam karboksilat termasuk dalam golingan asam lemah, yang berarti hanya terdisosiasi sebagian menjadi kation H+ dan sebagian lagi menjadi anion RCOO– dalam suatu larutan.Contoh, pada suhu ruangan, 1 M CH3COOH hanya terdisosiasi 0,4% saja. Adanya substituen elektronegatif (seperti halogen) menambah sifat keasaman.Berikut tabel
>>>Pembentukan/pembuatan asam karboksilat.
Sintesis mau pun senyawa,gugus fungsi, kimia, dalam pembuatannya, asam karboksilat yang paling sederhana dalam pembuatannya adalah Asam Metanoat dan asam Etanoat.
Secara industri, Asam metanoat dibuat secara dengan mereaksikan CO dan NaOH seerti reaksi berikut.
200 oC
| ||
CO + NaOH
|
→
|
HCOONa
|
katalis
| ||
HCOONa + HCl
|
→
|
HCOOH + NaCl
|
Nah dalam pembuatannya ini, dapat dilakukan dgn reaksi oksidasi etanol dari buah anggur atau pun sari buah lainnya dalam bentuk enzim.
PEMBUATAN rampart Di salad labor.
May mmelalui reaksi oksidasi etanol dengan oksidator K2Cr2O7 atau KMnO4.
Perhatikan reaksi berikut.
Asam karboksilat dapat dibuat dengan beberapa cara, di antaranya yakni
a) Dengan mengoksidasi alcohol primer
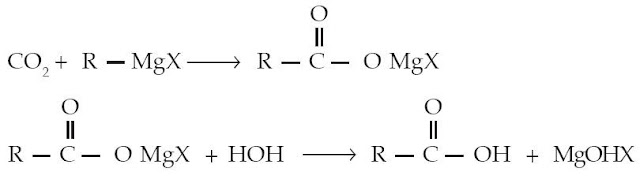
b) Dengan mereaksikan gas CO2 dengan pereaksi Grignard.
c) Dengan sintesis nitril, dimana dengan mereaksikan alkil halida (R – X) dengan NaCN atau KCN dalam larutan teralkohol membentuk alkana nitril,nah kemudian alkana nitril terhidrolisis membentuk asam karboksilat.
d) Asam formiat dibuat dengan mereaksikan gas karbonmonoksida dengan uap air, dengan katalisator oksida logam pada suhu sekitar 200 °C dan tekanan tinggi
, permasalahan
1.Dalam oksidasi alkohol primer dan aldehid dengan menggunakan katalis kuat dapat menghasilkan produk asam karboksilat. Apa yang akan terjadi dimana pada reaksi alkohol prumer dan aldehid tersebut menggunakan katalis lemah?
2.Mengapa asam karboksilat dengan panjang rantai 5-6 sedikit larut dalam air dan asam karboksilat dengan panjang rantai lebih dari 6 tidak larut dalam air.jelaskan dilihat dari pengaruh atom karbon dan unsur-unsur lainnya yang mengikat sehingga berpengaruh terhadap air.
3.Salah satu sifat fisik asam karboksilat ketika ditempatkan di pelarut non polar,asam karboksilat membentuk dimer melalui ikatan hidrogen antara gugus hidroksil dari satu asam karboksilat dan gugus karbonil lainnya. Bagaimana jika di tempatkan pada pelarut polar? .





Baiklah saya Kelantan (023) akan menanggapi permasalahan no.2
BalasHapusAsam karboksilat dengan panjang rantai 5-6 sedikit larut dalam air dan asam karboksilat dengan panjang rantai lebih dari 6 tidak larut dalam air. Hal ini dikarenakan asam karboksilat bersifat polar ketika memiliki rantai kecil (1 sampai 5 karbon) sehingga larut dalam air, sedangkan pada rantai yang lebih panjang semakin kurang larut disebabkan sifat hidrofobik dari rantai alkil.Semakin panjang dan banyak unsur yang akan berikan dengan asam karboksilat menjadikan asam karboksilat bersifat non polar sehingga semakin sulit larut dalam air.
Semoga membantu
Saya mashita NIM A1C118083 akan mencoba menjawab pertanyaan no 1
BalasHapusJika dioksidasi dengan menggunakan katalis kuat itu langsung akan menjadi asam karboksilat, tapi jika dioksidasi menggunakan katalis lemah tidak langsung menjadi asam karboksilat. Reaksi pembentukan asam karboksilat, alkohol pertama-tama dioksidasi menjadi aldehida yang selanjutnya dioksidasi menjadi asam karboksilat. Oksidasi untuk menjadi asam karboksilat untuk menggunakan zat pengoksidasi berlebih dan memastikan bahwa aldehida yang terbentuk sebagai produk setengah jalan tetap berada dalam campuran. Alkohol dipanaskan dengan refluks dengan zat pengoksidasi berlebih. Ketika reaksi selesai, asam karboksilat akan disuling.
ERMA JOHAR A1C118031
BalasHapusbaiklah saya akan mencoba menjawab no 3
Menurut saya , apabila dilarutkan dalam pelarut polar maka proses reaksinya akan sulit berjalan sehingga produk yang terbentuk akan tidak sesuao yang seharusnya