Turunan Asam Karboksilat
.1)) ESTER
>>>Ester merupakan suatu kelompok senyawak organik yangmana memiliki rumus umum RCOOR1. Ester ini termasuk turunan asam karboksilat yang gugusnya adlah –OH dalam rumus RCOOH diganti odgn gugus –OR1. Dengan demikian rumus umum ester adalah
TATANAMA ESTER
Pemberian nama pada ester diawali dengan menyebut nama gugus alkil atau aril yang menggantikan atom H dalam gugus –COOH pada asam asam karboksilat induknya kemudian di ikuti nama asam tersebut tanpa menyebut kata asam.
Contoh
Asam induk = CH3CH2CH2COOH
IUPAC = asam pentanoat
Trivial = asam valerat
Ester = CH3CH2CH2COOC2H5
IUPAC = etil pentanoat
Trivial = etil valerat
3-metilbutil asetat
Butil butanoat
Benzil butanoat
PEMBUATAN ESTER
Ester dibuat dengan mereaksikan alkohol atau fenol dengan asam karboksilat kemudian direfluks. Fenol yaitu senyawa organik dimana gugus -OH langsung terikat pada cincin benzena. Reaksi pembuatan ester disebut esterifikasi dan reaksi yang terjadi disebut reaksi esterifikasi Fischer. Reaksi esterifikasi merupakan reaksi reversibel yang sangat lambat, tetapi bila menggunakan katalis asam mineral seperti asam sulfat (H2SO4) dan asam klorida (HCl) kesetimbangan akan tercapai dalam waktu yang cepat. Pola umum dalam pembuatan ini dinyatakan dengan persamaan berikut
RCOOH + R1OH ↔ RCOOR1 + H2O
Dalam reaksi esterifikasi, ion H+ dari H2SO4 berperan dalam pembentukan ester dan juga berperan dalam reaksi sebaliknya yakni hidrolisis ester. Sesuai dengan hukum aksi massa, untuk memperoleh rendemen ester yang tinggi maka kesetimbangan harus bergeser ke arah pembentukkan ester. Untuk mencapai keadaan ini dapat ditempuh dengan cara:
a. Salah satu pereaksi digunakan secara berlebih. Biasanya alkohol dibuat berlebih karena murah dan mudah diperoleh.
b. Membuang salah satu produk dari dalam campuran reaksi
Laju reaksi esterifikasi suatu asam karboksilat bergantung pada halangan sterik dalam alkohol dan asam karboksilatnya. Dengan bertambahnya halangan sterik di dalam zat antara, laju pembentukkan ester akan menurun. Dengan demikian rendemen ester akan berkurang.
Esterifikasi dipengaruhi oleh beberapa faktor, diantaranya adalah struktur molekul dari alkohol, suhu dan konsentrasi reaktan maupun katalis. Kereaktifan alkohol terhadap esterifikasi: CH3OH > alkohol primer > alkohol sekunder > alkohol tersier
Kereaktifan asam karboksilat terhadap esterifikasi : HCOOH > CH3COOH > RCH2COOH > R2CHCOOH > R3CCOOH
Selain dibuart dari asam karboksilat, ester juga dapat diperoleh dengan cara mereaksikan suatu klorida asam atau suatu anhidrida asam dengan alkohol atau fenol. Reaksi pembuatan ester dari klorida asam dan anhidrida asam mengikuti pola umum reaksi berikut.
Klorida asam
RCOCl + R1OH → RCOOR1 + HCl
RCOCl + ArOH → RCOOAr + HCl
Anhidrida asam
(RCO)2O + R1OH → RCOOR1 + RCOOH
(RCO)2O + ArOH → RCOOAr + RCOOH
REAKSI-REAKSI ESTER
a. Reaksi hidrolisis
Reaksi hidrolisis ester dalam suasana asam menghasilkan asam karboksilat dan alkohol, namun bila reaksi hidrolisis dilangsungkan dalam suasana basa diperoleh garam karboksilat dan alkohol. Hidrolisis ester dengan basa dise4but reaksi Penyabunan (Saponifikasi).
b. Reaksi dengan Amonia
Produk reaksi antara ester dengan amonia adalah suatu amida dan suatu alkohol. Contoh : reaksi antara etil asetat dengan amonia menghasilkan asetamida dan etanol.
CH3COOC2H5 + NH3 → CH3CONH2 + C2H5OH
c. Transesterifikasi
Jika suatu ester direaksikan dengan suatu alkohol maka akan diperoleh ester baru dan alkohol baru. Reaksi ini disebut reaksi transesterifikasi yang dapat berlangsung dalam suasana asam dan basa mengikuti pola umum berikut ini.
RCOOR1 + R”OH ↔ RCOOR” + R1OH
Reaksi diatas disebut transesterifikasi karena terjadi pertukaran antara gugus alkil dalam –OR1 pada ester dengan gugus alkil dalam ikatan R”O.
Contoh reaksi antara suatu trigliserida dengan metanol.
d. Reaksi dengan pereaksi Grignard
Reaksi antara suatu ester dengan pereaksi Grignard merupakan cara istimewa dalam pembuatan alkohol tersier. Pola umum dari reaksi ini adalah sebagai berikut.
Bila keton yang diperoleh di atas direaksikan lebih lanjut dengan R’’MgX maka pada akhirnya diperoleh suatu alkohol terseir menurut persamaan reaksi berikut ini.
SIFAT FISIKA DAN KEGUNAAN ESTER
Ester yang memiliki 3 sampai 5 atom karbon dapat larut dalam air dan selebihnya tidak larut dalam air. Ester merupakan kelompok senyawa organik yang memiliki aroma yang wangi seperti bunga dan buah sehingga banyak digunakan sebagai pengharum (essence), sarirasa dalam industri makanan dan minuman. Ester yang digunakan biasanya yang berwujud cair pada suhu dan kamar.
Titik leleh dan titik didih ester lebih rendah dibanding asam karboksilat dan alkohol asamnya. Hal ini disebabkan dalam ester tidak terbentuk ikatan hidrogen antarmolekulnya sedangkan pada alkohol dan asam karboksilat terjadi ikatan hidrogen antarmolekulnya. Adanya ikatan hidrogen inilah yang menyebabkan titik leleh dan titik didih alkohol asalnya lebih tinggi.
Kelompok ester yang memiliki aroma buah disajikan pada tabel berikut ini, (dikutib dari wikipedia.org).
Strutur
|
Nama
|
Aroma atau terdapat di
|
Alil hexanoate
|
nenas
| |
Benzil asetat
|
pir , strawberry , melati
| |
butil butirat
|
Nenas
| |
Etil butirat
|
pisang, nanas, stroberi
| |
etil heksanoat
|
nanas, pisang lilin hijau
| |
etil sinamat
|
kayu manis
| |
Etil format
|
cherry, raspberry, strawberry
| |
Etil heptanoat
|
aprikot, ceri, anggur, raspberi
| |
Etil isovalerat
|
Apel
| |
Etil laktat
|
mentega, krim
| |
Etil nonanoat
|
anggur
| |
Etil pentanoat
|
Apel
| |
Geranil asetat
|
Pelargonium
|
2))ASIL HALIDA(Alkanoil halida).
>Asil halida merupakanasil yang paling reaktif diantara semua turunan asam karboksilat.
>Asil klorida lebih lazim dan lebih murah di bandingkan dari bromidan dan juga iodida.
>Asil halida cepat bereaksi dengan kebanyakan nukleofil ex: air, alkohol.
>>>tatanama)
~alkanoil + karbohalida
~Alkana + Karbohalida
~Penomoran dimulai dari pada X yang mengikat gugus karbonil.
Berikut adalah reaksi pembuatannya.
REAKSI ASIL HALIDA.
1.Reaksi dgn air membentuk asamnya.
Hal ini menyebabkan asil halida mempunyai bau yg mengiritasi. Ex: benzoil klorida>>gas air mata
2.Reaksi dgn alkohol membentuk ester
Konversi asam karboksilat yg menghasilkan bahan baku asil halida.metode ini memerlulan 2 langkah (Esterifikasi hanya 1 langkah). Reaksi ini di gunakan jika bahan baku mahal karena bukan reaksi kesetimbangan.
3.Reaksi dgn amonia membentuk Amida.
Reaksi ini lebih cepat dari pada amoAmonilisis ester. Namun 2 ekivalen amonia
Anhidrid Asama Alkanoat.
Anhidrit asam diturunkan dari asamdgn mengambil air dari 2 gugus karboksil dan juga menghubungkan pragmen-pragmennya
Dan tatanamanya itu cukup anhidrit + nama asam
>>Pembuatan Anhidrid Asam
1.Dehidrad asam
2.Reaksi asil halida dan garam karboksilat
Metode ini digunakan untuk mmembuat anhidrit asam yg mana di turunkan dr dua asam yang berbeda (anhidrit campuran).
3))REAKSI ANHIDRID ASAM.
>menjalani reaksi subtitusi asil nukleofilik
>Jauh lebih reakrif terhadap nukleofil n di banding ester, tetapinkurang reaktif dibandingkan asil halida.
Contohnya adalah Sintesis Aspirin
4))ALKANA KARBOAMIDA (AMIDA)
Karakteristiknya.
>amida ialah turunan dr pd CH3COOH Yg gugusnya -oh di gantikan oleh -NH2(primer),-NHR(sekunder) atau pun NR2 (tersier).
>amida paling tidak reaktif di antara turunan drpd asam karboksilat.
>amida yg paling penting adalah protein.
>Bentuk padat (kristal) kecuali formaldehida berbentuk cair.
>Tatanama : menggantikan akhiran -at atau oat pd asam dgn akhirn -amida.
 >Amida memiliki titik didih relatif tinggi.
>Amida memiliki titik didih relatif tinggi.
>Titik didih dan titik leleh menurun pada amida sekunder dan pun tersier.
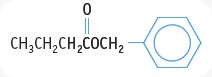
ASAM HIDROKSI ALKANOAT. (asam Hidroksi Karboksilat)
>>merupakan gabungan drpd gugus -COOH pada rantai karbon.
>>asam monohidroksi alkanoat : 1 gugus -OH
>>kemudian dihidroksi alkanoat : 2 gugus -OH. Berikut gambarnya.
Anhidrid Asama Alkanoat.
Anhidrit asam diturunkan dari asamdgn mengambil air dari 2 gugus karboksil dan juga menghubungkan pragmen-pragmennya
Dan tatanamanya itu cukup anhidrit + nama asam
>>Pembuatan Anhidrid Asam
1.Dehidrad asam
2.Reaksi asil halida dan garam karboksilat
Metode ini digunakan untuk mmembuat anhidrit asam yg mana di turunkan dr dua asam yang berbeda (anhidrit campuran).
3))REAKSI ANHIDRID ASAM.
>menjalani reaksi subtitusi asil nukleofilik
>Jauh lebih reakrif terhadap nukleofil n di banding ester, tetapinkurang reaktif dibandingkan asil halida.
Contohnya adalah Sintesis Aspirin
4))ALKANA KARBOAMIDA (AMIDA)
Karakteristiknya.
>amida ialah turunan dr pd CH3COOH Yg gugusnya -oh di gantikan oleh -NH2(primer),-NHR(sekunder) atau pun NR2 (tersier).
>amida paling tidak reaktif di antara turunan drpd asam karboksilat.
>amida yg paling penting adalah protein.
>Bentuk padat (kristal) kecuali formaldehida berbentuk cair.
>Tatanama : menggantikan akhiran -at atau oat pd asam dgn akhirn -amida.
 >Amida memiliki titik didih relatif tinggi.
>Amida memiliki titik didih relatif tinggi.>Titik didih dan titik leleh menurun pada amida sekunder dan pun tersier.
ASAM HIDROKSI ALKANOAT. (asam Hidroksi Karboksilat)
>>merupakan gabungan drpd gugus -COOH pada rantai karbon.
>>asam monohidroksi alkanoat : 1 gugus -OH
>>kemudian dihidroksi alkanoat : 2 gugus -OH. Berikut gambarnya.
Permasalahan.
1.produk yang terbentuk yakni amida merupakan reaksi antara ester dengan amoniak. Mengapa pada reaksi aminolisis tidak memerlukan katalis dalam reaksinya?
2.Apakah akan menghasilkan aspirin jika asam anhidrida di ganti dengan turunan asam karboksilat yang lain seperti asil klorida?
3.mengapa halida asam yang paling tidak reaksif


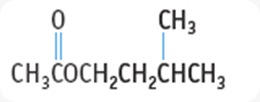
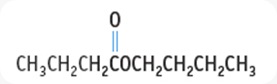
















Baiklah, saya Vika Seputri (A1C118086) akan menjawab permasalahan no.2 yaitu Apakah akan menghasilkan aspirin jika asam anhidrida di ganti dengan turunan asam karboksilat yang lain seperti asil klorida? jika asam anhidrida di ganti dengan turunan asam karboksilat yang lain seperti asil klorida, maka dapat dibuat aspirin, karena asil klorida mempunyai kereaktifan yang lebih dari pada turunan asam karboksilat yang lain. hal ini dapat diketahui dengan Keberadaan gugus karbonil dalam turunan asam karboksilat sangat menentukan kereaktifan dalam reaksinya, walaupun gugus karbonil tersebut tidak mengalami perubahan.
BalasHapusTerimakasih
Hai Sandi
BalasHapusSaya M Rizki Dwi Putra NIM A1C118006 Menjawab permasalahan nomor 1, dalam reaksi aminolisis mengapa tidak menggunakan katalis karena fungsi katalis disini hanya sebagai mempercepat reaksi sedangkan dalam reaksi aminolisis tidak perlu menggunakan katalis untuk mempercepat laju reaksi dan hanya membutuhkan panas dalam menjalankan reaksi.
assalamuaiakum sandi,saya yupita sri rizki (071) akan mencoba menjawab pertanyaan no 3
BalasHapusMenurut berbagai literatur yang saya baca, alasan mengapa Halida asam paling tidak reaktif adalah di sebabkan oleh tingkat elektrofitas nya. Jika elektrofitasnya naik maka molekul itu akan lebih reaktif
Dan pada kasus ini dari semua turunan asam karboksilat Halida asam memiliki tingkat elektrofitas yang rendah sehingga ini membuat Halida asam tidak reaktif