Merupakan reaksi eliminasi unimolekuler.
Molekularitas dalam kimia merupakan jumlah molekul yang bereaksi bersama dalam suatu reaksi elementer (satu tahap)[1] dan sama dengan jumlah koefisien stoikiometri reaktan dalam reaksi elementer ini.[2] Bergantung pada seberapa banyak molekul yang bereaksi bersama, reaksi dapat terjadi secara unimolekuler, bimolekuler atau trimolekuler.
Dalam suatu reaksi unimolekuler, suatu molekul tunggal menata ulang atom-atomnya sehingga membentuk molekul yang berbeda.[1] Reaksi ini diilustrasikan melalui persamaan
A-->P
dan dijelaskan oleh hukum laju orde pertama
d[A]/d[t]=-Kr[A]
di mana [A] adalah konsentrasi spesi A, t adalah waktu, dan kr merupakan konstanta laju reaksi.
Seperti dapat disimpulkan dari persamaan hukum laju, jumlah molekul A yang meluruh sebanding dengan jumlah molekul A yang ada. Contoh reaksi unimolekuler, adalah isomerisasi siklopropana menjadi propena:
Izomerization of cyclopropane.jpg
Reaksi unimolekuler dapat dijelaskan oleh mekanisme Lindemann-Hinshelwood.
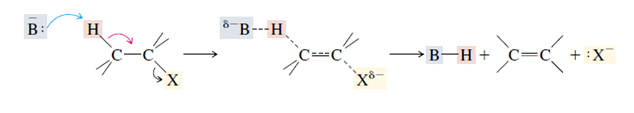
E1 terdiri dari dua langkah mekanisme yakni ionisasi dan deprotonasi.
-Ionisasi adalah putusnya ikatan karbon-Halogen membentuk ikatan intermediet karbokation.
-Deprotonas merupakan istilah kimia yang merujuk pada pelepasan sebuah proton (kation hidrogen H+) dari sebuah molekul, membentuk konjugat basa.
Reaksi E1 biasanya terjadi pada alkil halida tersier.Reaksi ini berlangsung tanpak kuat melainkan dengan basa lemah(dalam suasana asam dan suhu tinggi).
Reaksi E1 mirip dengan reaksi SN1 karena sama-sama menggunakan intermediet karbokation.
Langkah 1 (Ionisasi).
Langkah 2 (Deprotonasi)
EMekanisme reaksi E1 terdiri dari dua tahap. Perhatikan contoh berikut ini:
Tahap 1.
Tahap 1 reaksi E1 berjalan lambat.
Pertama terjadi tahap lambat dalam reaksi eliminasi dan merupakan tahap penentu laju dari reaksi keseluruhan. Reaksi E1 yang khas memperlihatkan kinetika order-pertama, dengan laju reaksi hanya bergantung pada konsentrasi alkil halidanya saja
Pada tahap ini,ionisasi aklikl halida atau subtrat berjalan lambat karena membutuhkan energi yang memecahkan subtrat dengan gugus perginya menjadi sebuah zat antara karbokation dan sebelumnya harus mencapai transisi.
Tahap 1 ini lambat,maka tahap ini adalah tahap penentu laju dan tahap ini hanya bergantung pada konsetrasi subtratnya saja.
Pada tahap ini,ionisasi aklikl halida atau subtrat berjalan lambat karena membutuhkan energi yang memecahkan subtrat dengan gugus perginya menjadi sebuah zat antara karbokation dan sebelumnya harus mencapai transisi.
Tahap 1 ini lambat,maka tahap ini adalah tahap penentu laju dan tahap ini hanya bergantung pada konsetrasi subtratnya saja.
Tahap 2.
Tahap 2 reaksi E1 berjalan cepat.
Dalam tahap dua terjadi perebutan sebuah protein yang dilakukan oleh basa dari atom karbon yang terdapat bersebelahan dengan karbon positif. Elektron ikatan sigma karbon hidrogen bergerak ke arah muatan yang positif, karbon itu mengalami Rehibridisasi dari keadaan sp3 ke keadaan sp2, dan terbentuklah suatu alkena.
Pada tahap ini,nukleofilik merebut karbokation ex(H) yang berdekatan dengan karbokationnya.Dengan syarat Hidrogen yang berseberangan bergeser ke karbon positif dimana keadaan Sp3 menjadi Sp2.
Pada tahap ini,nukleofilik merebut karbokation ex(H) yang berdekatan dengan karbokationnya.Dengan syarat Hidrogen yang berseberangan bergeser ke karbon positif dimana keadaan Sp3 menjadi Sp2.
Karena reaksi E1 berlangsung lewat zat antara karbokation, maka tidak mengherankan bahwa alkil halida tersier lebih cepat daripada alkil halida lain.
– terbentuknya karbokation
– terjadi pembentukan alkena sebab karbokation memberi proton pada basa
– proten dari atom C diambil oleh basa (beta, C yang bersebelaha
– terjadi pembentukan alkena sebab karbokation memberi proton pada basa
– proten dari atom C diambil oleh basa (beta, C yang bersebelaha
- Merupakan proses eliminasi dua-tahap: ionisasi dan deprotonasi.
- Ionisasi: ikatan karbon-halogen putus menghasilkan zat antara karbokation.
- Deprotonasi karbokation.
- E1 umumnya terjadi pada alkil halida tersier, tetapi mungkin terjadi pada beberapa alkil halida sekunder.
- Laju reaksi dipengaruhi hanya oleh konsentrasi alkil halida.
- Reaksi E1 bergantung pada subtratnya
- Reaksi biasanya terjadi pada ketiadaan basa atau hanya dalam kehadiran basa lemah (kondisi asam dan suhu tinggi).
- Dalam Reaksi E1 berkompetisi dengan mekanisme reaksi SN1 karena keduanya berbagi zat antara karbokationik yang umum.
- Efek isotop deuterium sekunder yang agak lebih besar dari 1 (biasanya 1 - 1.5) teramati.
- Tidak dibutuhkan antiperiplanar. Contohnya pada pirolisis pada suatu ester sulfonat tertentu pada mentol:
- Hanya produk reaksi A yang dihasilkan dari eliminasi antiperiplanar. Kehadiran produk B adalah indikasi bahwa mekanisme E1 terjadi.[3]
- Reaksi ini disertai dengan reaksi penataan ulang karbokationik.







Saya Wafiqah Alvia Ramadhani (047) akan menjawab pertanyaan No 3
BalasHapuskenapa hanya konsentrasi alkil halida yang mempengaruhi laju reaksi pada E1.menurut saya itu dikarnakan pembentukan karbokationnya merupakan tahap paling lambat, alias tahap penentu laju. Karenanya, kinetika orde pertama berlaku (unimolekular) atau E1.
Terimakasih.
Komentar ini telah dihapus oleh administrator blog.
BalasHapusKomentar ini telah dihapus oleh pengarang.
BalasHapusHai sandi, saya Nadiya, NIM 073. Akan mencoba menyelesaikan permasalahan pertama. Reaksi E1 hanya cenderung bereaksi pada alkil Halida tersier. hal tersebut dikarenakan suatu reaksi E1 berlangsung lewat zat antara karbokation, atau melewati tahap terbentukknya karbokation. maka tidak mengherankan jika alkil halida tersier lebih cepat daripada alkil halida lain. karbokation tersier lebih disukai dari pada alkil halida lain.
BalasHapusReaksi E1 adalah reaksi eliminasi dimana suatu karbokation dapat memberikan sebuah proton kepada suatu basa dan menghasilkan alkena.
Perkenalkan nama saya Jony Erwin (098) yang akan menjawab permasalahan no 2
BalasHapusKarena pada reaksi ini memerlukan waktu dalam pembentukan karbokation karna melaui proses yang lambat dimana kinetika orde pertama yang digunakan