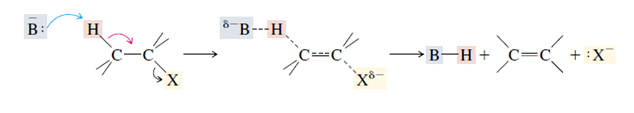
=> E2 merupakan singkatan dari eliminasi bimolekular. Reaksi tersebut melibatkan mekanisme satu-tahap di mana ikatan karbon-hidrogen dan karbon-halogen terputus untuk membentuk ikatan dua rangkap (ikatan piC=C).
Oleh karena itu,mekanisme reaksi E2 melibatkan 2 molekul yakni tahap reaksinya,
Dan hanya pada reaksi E2 akan menghasilkan stereospesifik namun tidak untuk reaksi E1.
Mekanisme tahapan reaksi E2
Dalam E2,yang lebih dominan adalah,
1.Substrat yang mengandung gugus pergi yang baik berkaitan dengan atom karbon tetraherbal.
2.Basa kuat non nukleofilik
3.Tidak terjadi pembentukan karbokation
4.pembentukan secara serempak
5.Produk Saitzeff umumnya produk utama :
Metode Penting Reaksi Eliminasi
Biasanya, reaksi eliminasi dibedakan berdasarkan jenis atom atau kelompok atom yang meninggalkan molekul. Karena ini, ada dua metode utama yang terlibat dalam jenis reaksi ini;
Dehidrasi
Dehidrohalogenasi
Dalam metode dehidrasi, ada penghilangan molekul air yang sebagian besar dari senyawa seperti alkohol. Kadang-kadang, metode ini juga disebut reaksi eliminasi Beta di mana kelompok yang meninggalkan dan H ditempatkan pada atom karbon tetangga. Di sisi lain, dalam dehidrohalogenasi, ada penghilangan atom hidrogen dan atom halogen.
Beberapa jenis reaksi eliminasi yang umum adalah eliminasi α dan γ- dan δ.
Selain itu, ini adalah metode penting untuk persiapan alkena.
Biasanya, reaksi eliminasi dibedakan berdasarkan jenis atom atau kelompok atom yang meninggalkan molekul. Karena ini, ada dua metode utama yang terlibat dalam jenis reaksi ini;
Dehidrasi
Dehidrohalogenasi
Dalam metode dehidrasi, ada penghilangan molekul air yang sebagian besar dari senyawa seperti alkohol. Kadang-kadang, metode ini juga disebut reaksi eliminasi Beta di mana kelompok yang meninggalkan dan H ditempatkan pada atom karbon tetangga. Di sisi lain, dalam dehidrohalogenasi, ada penghilangan atom hidrogen dan atom halogen.
Beberapa jenis reaksi eliminasi yang umum adalah eliminasi α dan γ- dan δ.
Selain itu, ini adalah metode penting untuk persiapan alkena.
Karakteristik mekanisme reaksi ini diantaranya:
- E2 adalah eliminasi satu tahap, dengan satu keadaan transisi.
- Biasanya E2 terjadi pada alkil halida primer tersubstitusi, tetapi mungkin juga terjadi pada alkil halida sekunder.
Dan pada buku fesennden juga menjelaskan bahwasannya bahwa dalam reaksi E2,juga terjadi alkil halida tersier bereaksi paling cepat dan alkil halida primer bereaksi paling lambat.bila di olah dengan suatu basa,alkil halida primer biasanya begitu mudah bereaksi substitusi sehingga hanya sedikit alkena terbentuk.
- Laju reaksinya mengikuti orde kedua, karena reaksi dipengaruhi baik oleh alkil halida dan basa (bimolekular).
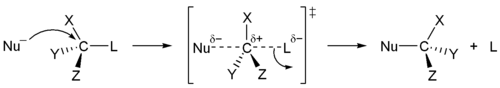
- Karena mekanisme E2 menghasilkan pembentukan ikatan pi, dua gugus pergi (terkadang sebuah hidrogen dan suatu halogen harus antiperiplanar. Keadaan transisk antiperiplanar memiliki konformasi goyang (staggered) dengan energi yang lebih rendah dibanding keadaan transisi sinperiplanar di mana konformasi eklips dengan energi yang lebih tinggi. Mekanisme reaksi yang melibatkan konformasi goyang lebih disukai pada reaksi E2 (tidak seperti reaksi E1)
- E2, kelompok yang meninggalkan selalu “anti” terhadap hidrogen yang dihilangkan pada karbon yang berdekatan. [Itu berarti bahwa mereka saling bertentangan, atau 180 °.
- E2 biasanya menggunakan basa kuat. Basa harus cukup kuat untuk melepas hidrogen yang kurang asam.
- Agar ikatan pi dapat terbentuk, hibridisasi karbon harus lebih rendah dari sp3 menjadi sp2.
- Ikatan C-H ilemahkan dalam tahap penentu laju dan arenanya efek isotop deuterium primer lebih besar dari 1 (biasanya 2-6) teramati.
- E2 berkompetisi dengan mekanisme reaksi SN2 jika basa dapat bertindak pula sebagai nukleofil (pada banyak basa yang umum).
Contoh tipe reaksi ini dalam skema 1 adalah reaksi isobitilbromida dengan kalium etoksida dalam etanol. Produk reaksi tersebut adalah isobitilena etanol dan kalium bromida.
Sumber:
https://id.m.wikipedia.org/wiki/Reaksi_eliminasihttps://www.academia.edu/24754276/Reaksi_Eliminasi
Fessenden, R.J. and Fessenden, J.S., 1982, Kimia Organik, diterjemahkan oleh Pudjaatmakan, A. H., Edisi Ketiga, Jilid 1, 237-239, Penerbit Erlangga, Jakarta.
1.Dari suatu materi yang di paparkan di blog saya,dikatakan bahwa hanya pada reaksi E2 akan menghasilkan stereospesifik namun tidak untuk reaksi E1.Mengapa demikian?
2.Mekanisme E2 menghasilkan pembentukan ikatan pi, dua gugus pergi (terkadang sebuah hidrogen dan suatu halogen harus antiperiplanar dan dijelaskan bahwa
Keadaan transisi antiperiplanar memiliki konformasi goyang (staggered) dengan energi yang lebih rendah dibanding keadaan transisi sinperiplanar di mana konformasi eklips dengan energi yang lebih tinggi. Dari kedua konformasi tersebut,konformasi yang manakah yang lebih di sukai oleh mekanisme E2?
3.mengapa pada reaksi E2 yang terbentuk adalah alkena ?